是誰發現酸雨
 1850年,英國化學家史密斯分析曼徹斯特地區的雨水時,發現城區與郊區雨水的化學組成成份並不相同,特別的是城區的雨水含有硫的成份。到了1872年,史密斯在他的著作《空氣和降雨:化學氣候學的開端》中,全球首次使用酸雨(Acid rain)這個術語,這就是酸雨名字的由來。
1850年,英國化學家史密斯分析曼徹斯特地區的雨水時,發現城區與郊區雨水的化學組成成份並不相同,特別的是城區的雨水含有硫的成份。到了1872年,史密斯在他的著作《空氣和降雨:化學氣候學的開端》中,全球首次使用酸雨(Acid rain)這個術語,這就是酸雨名字的由來。
 1850年,英國化學家史密斯分析曼徹斯特地區的雨水時,發現城區與郊區雨水的化學組成成份並不相同,特別的是城區的雨水含有硫的成份。到了1872年,史密斯在他的著作《空氣和降雨:化學氣候學的開端》中,全球首次使用酸雨(Acid rain)這個術語,這就是酸雨名字的由來。
1850年,英國化學家史密斯分析曼徹斯特地區的雨水時,發現城區與郊區雨水的化學組成成份並不相同,特別的是城區的雨水含有硫的成份。到了1872年,史密斯在他的著作《空氣和降雨:化學氣候學的開端》中,全球首次使用酸雨(Acid rain)這個術語,這就是酸雨名字的由來。
在50年代初期,北歐國家瑞典和挪威的漁業發現突然無故減產,人們開始尋找原因,經多方研究之後,發現與酸雨有關。原因是工業革命後,歐洲的工業排放出大量酸性氣體,順著氣流在空氣中飄流至北歐,當下雨時,那些酸性氣體就溶解進入雨水中,形成酸雨,落到湖中使得湖泊酸化,導致漁業減產。
到了60年代,歐洲開始關注酸雨問題,設立了大氣化學監測網,結果發現歐洲大陸存在著大面積的酸雨影響區域,而且從1973年至1975年歐洲經濟合作與發展組織開展了專項研究,証實酸雨地區幾乎覆蓋了整個西北歐,展現出酸雨問題已經是國際間的環境問題。
1974年以後美國也証實在美國東北部和與加拿大交界地區發現大面積酸雨區域,幾乎北美有三分之二陸地面積受到酸雨威脅,甚至在美國夏威夷群島的迎風一側,也出現酸雨。
繼美國發現酸雨之後,東南亞日本、韓國等亦發現有大面積區域的酸雨。這也顯示出酸雨問題不單單只是歐美的問題,就連亞洲地區也不能倖免。
80年代,有位科學家還到杳無人煙,且長年冰封雪覆蓋的格陵蘭島,在冰層上打鑽,取出180年前的冰塊,與現在的酸度相比,酸度增長了99倍。同時,挪威科學家在北極圈內大面積地區也都測到酸雨(酸雪)的蹤跡。

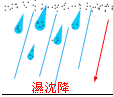 「酸雨」,顧名思義,雨是酸的。其正確的名稱應為「酸性沈降」,它可分為「濕沈降」與「乾沈降」兩大類,前者指的是所有氣狀污染物或粒狀污染物,隨著雨、雪、霧或雹等降水型態而落到地面者,後者則是指在不下雨的日子,從空中降下來的落塵所帶的酸性物質而言。在化學上定義水之pH(酸鹼)值等於7為中性,小於7則是酸性。自然大氣中含有大量二氧化碳,二氧化碳在常溫時溶解於雨水中並達到氣液相平衡後,雨水之酸鹼值約為 5.6,因此大自然的雨水是酸的;但是,在大自然中,仍存在其他致酸的物質,例如,火山爆發所噴出的硫化氫,海洋所釋放出的二甲基硫,高空閃電所導致之氮氧化物等,均會使雨水進一步酸化,而酸鹼值會降至 5.0 左右。因此,在 1980年代後期以來,許多國內外(包含環保署研究報告)研究者,已將所謂「酸雨」認知為當雨水酸鹼值在 5.0 以下時,即確定受到人為酸性污染物的影響。因此,在環保署研究報告中,已統一雨水酸鹼值達 5.0以下時,正式定義為「酸雨」。
「酸雨」,顧名思義,雨是酸的。其正確的名稱應為「酸性沈降」,它可分為「濕沈降」與「乾沈降」兩大類,前者指的是所有氣狀污染物或粒狀污染物,隨著雨、雪、霧或雹等降水型態而落到地面者,後者則是指在不下雨的日子,從空中降下來的落塵所帶的酸性物質而言。在化學上定義水之pH(酸鹼)值等於7為中性,小於7則是酸性。自然大氣中含有大量二氧化碳,二氧化碳在常溫時溶解於雨水中並達到氣液相平衡後,雨水之酸鹼值約為 5.6,因此大自然的雨水是酸的;但是,在大自然中,仍存在其他致酸的物質,例如,火山爆發所噴出的硫化氫,海洋所釋放出的二甲基硫,高空閃電所導致之氮氧化物等,均會使雨水進一步酸化,而酸鹼值會降至 5.0 左右。因此,在 1980年代後期以來,許多國內外(包含環保署研究報告)研究者,已將所謂「酸雨」認知為當雨水酸鹼值在 5.0 以下時,即確定受到人為酸性污染物的影響。因此,在環保署研究報告中,已統一雨水酸鹼值達 5.0以下時,正式定義為「酸雨」。
 一般酸水化學組成中,較重要的物種包括 H+、Cl-、NO3-、SO2-4、NH4+、K+、Na+、Ca2+及 Mg2+ 等九種。其來源包括自然來源及人為來源,如上圖所示,一般而言NO3-及 SO2-4 為主要的致酸物質,是由其硫氧化物與氮氧化物轉化而來。自然來源部份就是大自然本身產生的天然物質,例如:火山爆發時,噴出大量的硫化物;海水及湖水釋放的硫化氫;動植物分解後釋出的有機酸;泥土中的微生物及海藻釋放之硫化氫及氮化物等,都會讓雨水變酸,不過由於這些物質數百萬年來就一直存在,本來就會讓雨水變酸,不過低於pH值5.0的情況多是由於加上人為排放所造成的結果。
一般酸水化學組成中,較重要的物種包括 H+、Cl-、NO3-、SO2-4、NH4+、K+、Na+、Ca2+及 Mg2+ 等九種。其來源包括自然來源及人為來源,如上圖所示,一般而言NO3-及 SO2-4 為主要的致酸物質,是由其硫氧化物與氮氧化物轉化而來。自然來源部份就是大自然本身產生的天然物質,例如:火山爆發時,噴出大量的硫化物;海水及湖水釋放的硫化氫;動植物分解後釋出的有機酸;泥土中的微生物及海藻釋放之硫化氫及氮化物等,都會讓雨水變酸,不過由於這些物質數百萬年來就一直存在,本來就會讓雨水變酸,不過低於pH值5.0的情況多是由於加上人為排放所造成的結果。
 在人為污染排放方面,硫氧化物則與化石燃料使用、火力電廠、含硫有機物燃燒有關;氮氧化物主要源自工廠高溫燃燒過程及交通工具排放等過程,這些污染物被排放至大氣當中,經光化學反應生成硫酸、硝酸等酸性物質,使得雨水之pH值降低,形成酸雨。不過環境當中也是會有一些物質提供的酸鹼中和的機制像是Ca2+ 及 NH4+ 就為主要的中和(致鹼)物質。
在人為污染排放方面,硫氧化物則與化石燃料使用、火力電廠、含硫有機物燃燒有關;氮氧化物主要源自工廠高溫燃燒過程及交通工具排放等過程,這些污染物被排放至大氣當中,經光化學反應生成硫酸、硝酸等酸性物質,使得雨水之pH值降低,形成酸雨。不過環境當中也是會有一些物質提供的酸鹼中和的機制像是Ca2+ 及 NH4+ 就為主要的中和(致鹼)物質。
在此要釐清一個觀念,雨水 pH 值之高低與否,並不全然代表雨水中人為污染物是多還是少,因為除了上述酸性離子外,也存在其他如銨根、鈣、鎂等鹼性離子,以中和其酸性,而雨水的pH值則是由以上離子平衡後之氫離子所計算得來的。換言之,雨水中若有高濃度之硫酸根與硝酸根離子,但因有其他鹼性離子中和的時候,那麼雨水未必呈現酸性反應(即低pH值),反之亦然。所以雨水的pH值無疑地是可以作為一項先期指標,但更重要的是必須進一步進行雨水化學成份分析,了解其污染物來源,並計算隨雨水沈降至地表的污染物通量(即所謂沈降量,以公斤/公頃/年為單位),進而制定控制策略以改善之。
pH值也就是酸鹼值,是用來判斷液體為酸性或鹼性的單位。它和水中所含之氫離子濃度有關,他們的關係為pH=-log[H+],所以看水中含有多少氫離子濃度,可以判定水到底為酸性或鹼性。還記得嗎?在國中、高中的實驗課裡,我們就常用石蕊試紙來量測液體的pH值。
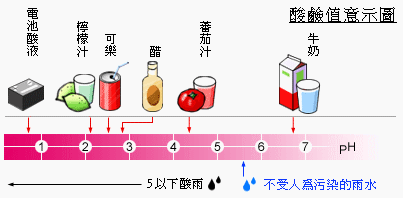 pH 值之範圍介於 0~14 之間,pH 值為7時表中性,pH 值比 7大為鹼性,比 7小時為酸性;pH 值之單位是用對數表示,即pH相差1其強度就差 10 倍,如 pH 3 就比 pH 4 酸性強了 10 倍。純水的pH值為 7,代表中性。下圖說明 pH 值小於7的液體,也就是酸性溶液: 牛奶略小於7,番茄汁略大於 4,醋約 3,檸檬汁為 2,一般雨水則為5 左右。
pH 值之範圍介於 0~14 之間,pH 值為7時表中性,pH 值比 7大為鹼性,比 7小時為酸性;pH 值之單位是用對數表示,即pH相差1其強度就差 10 倍,如 pH 3 就比 pH 4 酸性強了 10 倍。純水的pH值為 7,代表中性。下圖說明 pH 值小於7的液體,也就是酸性溶液: 牛奶略小於7,番茄汁略大於 4,醋約 3,檸檬汁為 2,一般雨水則為5 左右。
 形成酸雨的化學污染物主要是二氧化硫,而氮氧化物也是原因之一。這些化學氣體的來源是發電廠、工廠、車輛、船隻和飛機等等。二氧化硫(SO2),是當含硫的煤及燃油燃燒時所產生的。目前,燃燒煤作燃料的情況仍然普遍。煤含有一種雜質,它就是硫,在燃燒時,酸性氣體 SO2就會被排放出來。除了發電廠及石油工業中產生之外,金屬鎔煉過程中,來氧化硫礦中的金屬礦石時也會被產生。SO2會在空氣中被氧化成硫酸根SO42-。首先,二氧化硫與氧產生反應,造成三氧化硫。其過程非常複雜,有時還會涉及碳氫化合物及錳、銅、鐵等金屬離子。若有水蒸氣存在時,三氧化硫會溶在水蒸氣中,形成硫酸,在空氣中凝結成水點。或者,在空中被雨水溶解,成為雨水中的硫酸根。燃燒煤時產生的高溫熱力會使氧氣與氮氣化合,形成酸性氣體氮氧化物(NOx)。空氣中之氧,氮化物及金屬催化物發生化學反應,形成二氧化氮、無機性的硝酸鹽,或過氧硝酸乙醯脂(PAN)等物質。最後,這些物質被微粒表面吸收,轉變為無機性硝酸鹽或硝酸,硝酸再與氨產生反應,生成硝酸銨(NH4NO3),於是硝酸根和銨離子便會製造出來。其實,雨水沖刷污染物之過程可分兩個階段,首先,污染物在雨滴形成之初期即被吸收,降雨時直接與雨水一起降下,這種形成方式稱為雨除作用(Rainout),跟隨的是雨沖作用(Washout),雨滴在降落過程中﹐與下層的酸氣接觸及摩擦,而令酸性氣體溶在雨中,連隨下降至地面。
形成酸雨的化學污染物主要是二氧化硫,而氮氧化物也是原因之一。這些化學氣體的來源是發電廠、工廠、車輛、船隻和飛機等等。二氧化硫(SO2),是當含硫的煤及燃油燃燒時所產生的。目前,燃燒煤作燃料的情況仍然普遍。煤含有一種雜質,它就是硫,在燃燒時,酸性氣體 SO2就會被排放出來。除了發電廠及石油工業中產生之外,金屬鎔煉過程中,來氧化硫礦中的金屬礦石時也會被產生。SO2會在空氣中被氧化成硫酸根SO42-。首先,二氧化硫與氧產生反應,造成三氧化硫。其過程非常複雜,有時還會涉及碳氫化合物及錳、銅、鐵等金屬離子。若有水蒸氣存在時,三氧化硫會溶在水蒸氣中,形成硫酸,在空氣中凝結成水點。或者,在空中被雨水溶解,成為雨水中的硫酸根。燃燒煤時產生的高溫熱力會使氧氣與氮氣化合,形成酸性氣體氮氧化物(NOx)。空氣中之氧,氮化物及金屬催化物發生化學反應,形成二氧化氮、無機性的硝酸鹽,或過氧硝酸乙醯脂(PAN)等物質。最後,這些物質被微粒表面吸收,轉變為無機性硝酸鹽或硝酸,硝酸再與氨產生反應,生成硝酸銨(NH4NO3),於是硝酸根和銨離子便會製造出來。其實,雨水沖刷污染物之過程可分兩個階段,首先,污染物在雨滴形成之初期即被吸收,降雨時直接與雨水一起降下,這種形成方式稱為雨除作用(Rainout),跟隨的是雨沖作用(Washout),雨滴在降落過程中﹐與下層的酸氣接觸及摩擦,而令酸性氣體溶在雨中,連隨下降至地面。
當空氣污染物自排放源釋放至大氣後,可能會經下列過程後,而形成酸雨到達地面:
 輸送(transport):排放於大氣的污染物,被風吹到下風處,而被周圍空氣所混合及稀釋,其程度視風向及風速而有所不同。
輸送(transport):排放於大氣的污染物,被風吹到下風處,而被周圍空氣所混合及稀釋,其程度視風向及風速而有所不同。
 擴散(diffusion):主要是指大氣的垂直擴散能力,污染物不僅隨盛行風作水平方向的輸送,同時也在垂直方向擴散。
擴散(diffusion):主要是指大氣的垂直擴散能力,污染物不僅隨盛行風作水平方向的輸送,同時也在垂直方向擴散。
 轉化(transformation):污染物滯留於大氣中時,常發生物理、化學或生物反應,而轉化為其他物質致酸。
轉化(transformation):污染物滯留於大氣中時,常發生物理、化學或生物反應,而轉化為其他物質致酸。
形成酸湖,酸雨中和湖中碳酸氫根後,再讓湖水變酸,當pH值低於5.0時,會先導致湖中藻類種類減少,接著蝦類大量死亡,接著則是魚類的滅絕。(在歐美,酸雨所引起的湖泊酸化情形十分嚴重,如瑞典內湖泊共有八萬五千個,其中約有二萬多個已受到酸雨的影響。挪威有二百六十五個湖泊已經沒有魚蝦;而加拿大已有四百個「死湖」,以前有鮭魚的河川,現在都看不到鮭魚的蹤影了。)
土壤中含有大量鋁的氫氧化物,土壤酸化後,可加速土壤中含鋁礦物的風化而釋放出大量鋁離子,形成植物可吸收的形態鋁化合物。植物長期和過量的吸收鋁,會中毒,甚至死亡。酸雨能加速某些礦物質元素流失,由於營養少了,土壤貧脊,植物難以正常發育,由於抵抗力差了,植物病蟲的蟲害出現,使農作物減產,農地甚至會出現荒漠化現象。
(曾有農民發現種植的蔬菜菜葉在雨後變黃,甚至出現像「燒焦」的現象)整個森林也會被摧毀。(例如德國的森林)阿爾卑斯山和西德黑森林,西德,瑞士、英國等的森林中,半數以上的樹木也呈枯黃,枝葉掉落。在加拿大魁北克,在受損嚴重的山區,絕大部份的樹木已經枯萎。另外,美國的針葉林也遭受傷害。


德國賀騰 (Herten) 地方一座雕像,比較1908年(左)與1969年(右)所照的相片,可以清楚地顯示酸雨對大理石所造成的腐蝕作用。 酸雨還會腐蝕建築物、古跡、金屬物品及露天藝術品等,造成經濟、財物及文化的損失。(例如希臘神殿、羅馬遺畺和德國大臈堂等歷史文物均受到酸雨的侵蝕)

